O transplante de órgãos de suínos para humanos tem o potencial de reduzir dois grandes problemas da saúde pública do Brasil: as filas cada vez maiores de pessoas que aguardam transplantes de órgãos e os gastos de bilhões de reais em hemodiálise (máquina que faz aquilo que um rim doente não consegue mais: limpar o sangue).
Segundo dois dos principais pesquisadores deste tipo de transplante no Brasil, o potencial é enorme para quem precisa de rim, coração, pele e córnea.
Isso porque, pela primeira vez em décadas de estudos, existe um método eficiente para produzir órgãos adicionais (ou seja, além dos órgãos de pessoas com morte cerebral ou de pessoas que doam um dos rins, por exemplo).
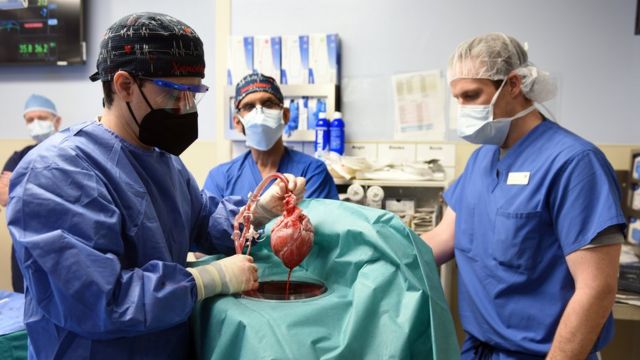
Em janeiro deste ano, um americano de 57 anos se tornou a primeira pessoa no mundo a receber um transplante de coração de um porco geneticamente modificado (os cientistas mudam os genes dos animais para evitar a rejeição pelo corpo humano).
Mas ainda há pelo menos quatro desafios enormes para que este tipo de transplante se torne uma realidade no Brasil e em outros lugares do mundo.
Dois deles são prevenir a rejeição pelo corpo humano e evitar a transmissão de doenças.
Em resumo, os cientistas fazem mudanças nos genes dos porcos para não deixar o sistema de defesa do corpo humano lutar contra os órgãos transplantados, e também adotam o máximo de cuidado possível para impedir que os órgãos estejam contaminados por vírus (ou outros invasores).
Outro obstáculo importante deste tipo de procedimento, chamado de xenotransplante, é a necessidade de autorização de órgãos reguladores (como a Anvisa fez ao analisar e autorizar as vacinas contra covid-19) e aprovação de lei federal para estabelecer as regras desta prática.
“Isso porque a lei brasileira não cita transplante de animais, a gente só tem transplante de humanos na lei brasileira. Precisa de uma readequação, uma vez que disponível este tipo de transplante para a sociedade brasileira”, explica o médico Gustavo Ferreira, presidente da Associação Brasileira de Transplantes de Órgãos (ABTO).
Ferreira diz que não é possível estimar ainda quanto tempo deve levar até que estes passos sejam concretizados porque tudo depende dos resultados dos testes clínicos, entre outras informações. Na prática, isso significa comprovar com muitos dados que este tipo de transplante é eficaz, ético e seguro, por exemplo.
Mas, para os pesquisadores envolvidos com xenotransplante no Brasil, o principal desafio ainda é a falta de dinheiro suficiente para implementar o projeto.
Na melhor das hipóteses, ou seja, se houver dinheiro e a implementação não sofrer atrasos ou problemas inesperados, o primeiro transplante será feito em 2025, estima Mayana Zatz, bióloga, geneticista e professora da Universidade de São Paulo (USP), em entrevista à BBC News Brasil.
Ela é uma das coordenadoras do projeto de xenotransplantes no Brasil, iniciado há quatro anos para tentar ampliar a oferta de órgãos para transplantes, com apoio do setor público e do setor privado.
Em março deste ano, o governo de São Paulo anunciou um investimento de quase R$ 50 milhões para o desenvolvimento de pesquisas sobre xenotransplantes, que também têm recursos da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) e de uma farmacêutica privada (EMS).
O Brasil é o segundo país do mundo que mais realiza transplantes (90% deles no sistema público de saúde, o SUS): foram quase 15 mil transplantes (rins representam um terço deste total) em 2020.
Mas a quantidade de órgãos disponíveis é cada vez menor do que o número de pessoas que precisam deles. Há cerca de 50 mil pessoas na fila de espera por um órgão no Brasil — e cerca de 7 delas morrem por dia enquanto aguardam pelo transplante, estima a Associação Brasileira de Transplante de Órgãos. O tempo médio do paciente na hemodiálise, à espera do transplante, é cerca de seis anos.
No projeto, uma espécie de porco que vive na Nova Zelândia, considerada ideal para transplantes para humanos, será clonada numa fábrica a ser construída em São Paulo. Nesta fábrica, a primeira da América Latina, estes animais vão viver até atingirem um tamanho adequado para a retirada dos órgãos a serem transplantados para humanos.
A primeira fase do projeto prevê produzir 30 animais por mês — e envolverá primeiro os rins. Ou seja, podem ser feitos 60 transplantes de rins por mês.
Ainda não é possível saber quantos órgãos serão produzidos por ano até o fim desta década nestas indústrias no Brasil, quanto custará cada um destes órgãos e nem que pacientes serão escolhidos para estes transplantes (hoje apenas casos extremos são escolhidos).
Mas a tendência é que, ao longo do tempo, estes órgãos suínos sejam transplantados para cada vez mais pessoas e reduzam os gastos com saúde pública (afinal, a fila única com pacientes da rede privada e da rede pública continuará existindo). A economia de recursos está ligada principalmente a pessoas com doenças nos rins que precisam de hemodiálise, que é o maior gasto setorial do SUS.
“A incidência da morte cerebral é fixa. Ela não aumenta e não vai aumentar porque depende de acidentes, agressões por tiro, quedas”, explica o médico cirurgião Silvano Raia, pesquisador da USP e um dos coordenadores do projeto de xenotransplantes. Raia é pioneiro no transplante de órgãos no país, tendo participado do primeiro transplante de fígado do mundo com doador vivo, por exemplo.
“Mas a demanda por órgãos tem aumentado porque a população tem vivido mais tempo em todos os países, porque as moléstias, as doenças renais, por exemplo, têm mais tempo para surgir e atingir fases em que só uma substituição do órgão [transplante] pode curar. Esta demanda tende a aumentar. Hoje, é difícil prever quando serão equilibradas oferta e demanda. Teoricamente, será uma benção, mas ainda não podemos prever quando”, completa.
CRÉDITO,UMSOM
4 grandes desafios para o xenotransplante
Há diversos obstáculos para o transplante de órgãos de outros animais para os humanos. Entre os maiores desafios, estão produzir porcos em condições ideais, evitar a transmissão de doenças, evitar que o corpo humano rejeite esses órgãos e mudar as leis e normas para autorizar xenotransplantes no Brasil.
Desafio 1: produzir porcos em condições ideais
Tudo começa com uma espécie de porcos considerada a mais “limpa” de todas. Isso porque estes animais viveram isolados por quase 200 anos na ilha de Auckland, da Nova Zelândia, e não têm doenças comuns em outros porcos ao redor do mundo.
Estes animais, que foram levados para lá por navios ingleses há três séculos, têm outra vantagem para o xenotransplante: eles não passam de 130kg, ou seja, têm órgãos na fase inicial com tamanho equivalente aos dos humanos — no Brasil, algumas espécies chegam a 300 kg.
O projeto brasileiro de xenotransplante fechou um acordo com a Nova Zelândia para receber embriões (estágio inicial do desenvolvimento de um ser vivo) congelados destes porcos.
Há três passos importantes aqui: edição genética, clonagem e barriga de aluguel.
A edição genética envolve técnicas como nocaute e adição de genes dos porcos que tentam evitar que o corpo humano ataque o órgão transplantado. A clonagem é o processo de multiplicação destes porcos considerados ideais. E a barriga de aluguel é a gestação destes porcos geneticamente modificados por porcas não modificadas.
A gestação natural duraria quatro meses, mas ela vai ser interrompida no terceiro mês.
Como as porcas gestantes não serão geneticamente modificadas, o parto precisará seguir uma série de cuidados rigorosos para não contaminar o feto com os germes vivos da mãe e nem com germes do ambiente, explica Raia.
Na sala de parto, a mãe é sacrificada, e o útero será retirado dela com o feto dentro. Na sala de enfermagem, uma equipe de enfermeiros será responsável por abrir o útero e tratar o filhote recém-nascido. Em seguida, este porco será colocado numa incubadora por um mês, até atingir o peso ideal (entre 30kg e 35kg).
Neste momento, o porco passará por uma nova cirurgia em que será sacrificado e serão retirados o coração, os rins e as córneas. Estes órgãos serão preenchidos por um líquido que evita danos, transportados para o hospital e transplantados para humanos.
Todas estas fases ocorrerão em módulos isolados e estéreis (não infectados), para permitir que várias fases sejam realizadas ao mesmo tempo e evitar contaminação.
Desafio 2: evitar transmissão de doenças que afetam suínos
A possibilidade de transmissão de doenças de outros animais em procedimentos de saúde com humanos sempre foi uma das grandes preocupações em torno destes estudos.
O primeiro paciente humano a receber um coração suíno, aliás, testou positivo para o citomegalovírus suíno, apesar dos testes feitos antes do transplante e do uso preventivo de remédios, segundo artigo publicado na revista especializada The New England Journal of Medicine. Este vírus costuma ser associado em suínos à rinite e a infecções generalizadas.
O paciente morreu 60 dias depois do transplante. Segundo os cientistas da Universidade de Maryland, nos EUA, envolvidos neste xenotransplante, ainda não é possível determinar se o citomegalovírus está ligado à falha do coração que levou à morte do paciente, mas é uma hipótese considerada provável por cientistas.
Há outras hipóteses possíveis para a falha do coração — entre elas, o uso de um remédio destinado a evitar tanto infecções quanto ataques do sistema de defesa do corpo humano contra as células suínas.
“Este tipo de remédio contém anticorpos [células de defesa] contra células suínas que podem ter interagido com o coração suíno, causando uma reação que teria machucado o músculo do coração”, afirma um comunicado da Universidade de Maryland.
Segundo Kapil Sahari, professor da Universidade de Maryland, a descoberta do citomegalovírus no paciente transplantado levou à implantação de um plano de segurança no hospital contra a “transmissão de qualquer patógeno [organismo que causa doença] conhecido ou desconhecido de suínos para profissionais de saúde e outros pacientes”.
Para Zatz, houve um aprendizado enorme com este xenotransplante pioneiro, que deve ser considerado um sucesso porque o paciente teve uma sobrevida de 60 dias — ou seja, três vezes mais que o primeiro paciente que recebeu um transplante de coração humano, em 1967, na África do Sul. “A gente aprende em cada um destes casos”, afirma.
Um dos aprendizados, por exemplo, é o aumento do rigor e da profundidade dos testes realizados para encontrar possíveis vírus nos órgãos suínos.
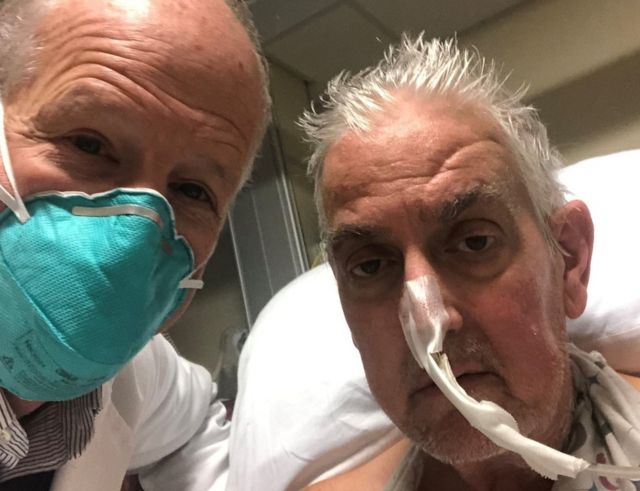
CRÉDITO,UNIVERSITY OF MARYLAND SCHOOL OF MEDICINE. David Bennett (à direita) foi a primeira pessoa a receber um coração suíno por meio de um transplante
Desafio 3: evitar que o corpo humano rejeite o órgão transplantado
O obstáculo talvez mais comum entre pacientes que receberam transplantes é evitar a rejeição. Ou seja, impedir que seu próprio corpo ache que o novo órgão é um invasor e comece a atacá-lo. Seja de humanos, seja de suínos.
O corpo não rejeita o órgão inteiro transplantado, mas pequenos pedaços dele. Por isso, os órgãos suínos passaram a ser modificados geneticamente para evitar essa rejeição.
No coração suíno transplantado nos Estados Unidos, dez genes que causavam rejeição aguda ou hiperaguda foram modificados, por exemplo. E ter superado essa barreira de rejeição tão forte foi considerado um avanço enorme para a ciência.
“Qualquer transplante que você faz tem possibilidade de rejeição. Qualquer pessoa que sofre um transplante tem que tomar remédios imunossupressores [que ‘enfraquecem’ o sistema de defesa do corpo e evitam a rejeição do órgão transplantado] a vida inteira”, afirma Zatz.
“Se de humanos, tem rejeição, imagina de porco para humano. Mas a gente vai aprender como lidar com essa rejeição. Provavelmente vão ser criadas novas drogas imunossupressoras. Mas não temos ilusão de que não haja reversão [que o órgão transplantado precise ser retirado], por enquanto”
Uma alteração importante no coração suíno foi a remoção de uma molécula de açúcar chamada alfa-Gal, que adere à superfície das células dos porcos e age como se fosse um sinal luminoso de neon gigante que marca o tecido como sendo totalmente estrangeiro ao corpo humano.
Uma parte do nosso sistema imunológico humano, chamado de sistema complementar, patrulha constantemente o corpo em busca de alfa-Gal. E é por isso que os órgãos podem ser rejeitados e mortos momentos após o transplante.
Até agora, não foi identificado nenhum sinal de rejeição do primeiro coração suíno transplantado para humanos. Mas se a análise detalhada do coração demonstrar sinais de ataque do sistema imunológico, os cientistas precisarão realizar outras modificações para tornar os órgãos suínos adequados ao corpo humano.
Desafio 4: questões éticas, mudança na lei e autorização para xenotransplantes
Os cientistas ao redor do mundo que trabalham com transplantes de órgãos suínos chegaram a uma conclusão recentemente: a fase de testes em laboratório acabou, e agora é hora de começar os testes clínicos (como o primeiro transplante de coração suíno nos Estados Unidos).
Se tudo der certo, o passo seguinte será começar a oferecer transplantes com órgãos suínos para quem precisa, como acontece com transplantes humanos.
Mas todas estas fases dependem de autorizações dos órgãos reguladores, como a Agência Nacional de Vigilância Sanitária (Anvisa). É algo parecido com o que aconteceu com as vacinas contra a covid-19. Os testes pré-clínicos e clínicos e a autorização definitiva tiveram aval da Anvisa.
Apesar do transplante de coração realizado nos EUA, a FDA (agência americana mais ou menos equivalente à Anvisa e referência regulatória para o resto do mundo) ainda não aprovou definitivamente que um órgão animal puro ou geneticamente modificado seja usado para xenotransplantes em humanos.
O que houve naquele caso foi uma autorização para uso compassivo (permissão para o uso da medicina experimental como último recurso) num contexto de estudos científicos.
Em artigo sobre xenotransplantes, um trio de pesquisadoras da área do direito, ligadas à Universidade Estadual Paulista (Unesp) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), aponta diversos desafios jurídicos e éticos em relação ao transplante de órgãos de outros animais.
“Caso a xenotransplantação se torne realidade no Brasil, precisarão ser apontadas algumas soluções ético-jurídicas que salvaguardem a questão da escassez de órgãos humanos, mas que viabilizem a proteção da dignidade animal, evitando as intervenções meramente experimentais, e priorizando as terapêuticas”, escrevem Maria Amália Alvarenga, Patricia Marchetto e Gabriela Bunhola.
Uma das medidas para garantir a dignidade animal seria, por exemplo, minimizar o máximo possível o sofrimento dele, com o uso de anestesia e só fazer testes em animais quando não houver outra alternativa (como simulações em computadores).
Na avaliação das pesquisadoras, será necessária a criação de uma lei específica para xenotransplantes, ainda que não haja nenhuma proibição na lei contra esta prática, além da autorização de comissões de ética para o uso de animais.
Por fim, o trio de especialistas defende que o procedimento de transplante de órgãos de outros animais não leve à morte destes animais. Ou seja, algo parecido com o que diz a lei de transplantes humanos (n. 9.434/97): “Só é permitida a doação referida neste artigo quando se tratar de órgãos duplos, de partes de órgãos, tecidos ou partes do corpo cuja retirada não impeça o organismo do doador de continuar vivendo sem risco para a sua integridade”.
“Neste caso, ficaria vedado o transplante de órgãos vitais dos animais, como o coração ou o fígado, por exemplo, mas seria possível a doação de seus rins. Isto não solucionaria o problema dos doadores que aguardam os órgãos vitais, ficando estes a cargo de transplantes post mortem (depois de morrer) apenas na modalidade humana, e evitando o abate excessivo dos animais que estariam sujeitos à xenotransplantação”, afirmam Alvarenga, Marchetto e Bunhola.
Em artigo sobre o mesmo tema, a professora e pesquisadora de direito penal Denise Luz, da Universidade de Pernambuco, lembra que atualmente não há nem órgãos suficientes para todas as pessoas que precisam de transplantes, nem alternativas que não sejam os animais — há estudos em andamento sobre órgãos artificiais ou criados em laboratório, mas isso está ainda mais distante da realidade.
“Diante desta realidade, da falta de ‘recursos alternativos’ para suprir a demanda por órgãos para transplante e a necessidade de validação científica das pesquisas, parece justificável, pelo menos em termos de direito penal, o uso de animais em pesquisas laboratoriais para tal fim”, escreve Luz.
A expressão “recursos alternativos” é uma referência ao artigo 32 da lei 9.605/98, conhecida como Lei de Crimes Ambientais. Segundo este trecho da lei, comete crime “quem realiza experiência dolorosa ou cruel em animal vivo, ainda que para fins didáticos ou científicos, quando existirem recursos alternativos”.
CRÉDITO,GETTY IMAGES. Ferramentas de edição genética podem fazer com que os transplantes feitos com órgãos de animais sejam mais seguros
Katrien Devolder, pesquisadora de bioética da Universidade de Oxford, no Reino Unido, disse em entrevista à BBC que só deveríamos usar suínos geneticamente modificados para transplantes de órgãos se “garantirmos que eles não sofram nenhum dano desnecessário”.
“Usar porcos para produzir carne é muito mais problemático que usá-los para salvar vidas. Mas, obviamente, não há razão para ignorarmos o bem-estar dos animais nessa prática”, afirmou Devolder.
Como fica claro, o tema dos xenotransplantes ainda será alvo de intenso debate nos próximos anos ao redor do mundo, até que a prática se torne uma realidade para muita gente.
Sequenciamento genético e o impacto para o xenotransplante
Como se descobre que genes os porcos têm e quais deles podem causar rejeição em humanos? Tudo começa com o sequenciamento do código genético, ou seja, mapear cada um dos 20 mil genes humanos e entender como cada um deles funciona.
O primeiro foi feito no início dos anos 2000, envolveu centenas de pesquisadores e custou bilhões de dólares. “Quando se estudou o genoma humano, se viu que existe 98% de semelhança entre o genoma humano e o genoma de suínos. Isso permitiu que a gente identificasse nos suínos quais são os genes que causam rejeição aguda”, explica Zatz.
A tecnologia avançou muito nas últimas duas décadas, e atualmente é possível obter o seu sequenciamento completo do genoma (informação necessária para construir o corpo humano e mantê-lo saudável) pelo equivalente a cerca de R$ 500 em alguns países.
No Reino Unido, por exemplo, o sistema público de saúde (NHS, na sigla em inglês) oferece esse sequenciamento para pacientes com alguns tipos de câncer.
Quando cientistas reúnem o genoma de milhares de pessoas com doenças ou não, eles podem começar a identificar quais combinações específicas de alterações genéticas — as chamadas “assinaturas mutacionais” — podem ser a chave para o desenvolvimento de doenças como o câncer. A maioria dos cânceres é causada por células com alterações incomuns no genoma.
Além disso, este tipo de tecnologia pode ajudar a identificar quais são os melhores tratamentos para cada doença em cada pessoa.
Um dos fatores mais importantes para este tipo de pesquisa é a diversidade genética. Ou seja, garantir que os bancos de dados genéticos não sejam restritos aos dados de uma população específica. Um trabalho do qual Zatz participou fez o sequenciamento genético de mais de 1,5 mil idosos brasileiros — e foram achadas 2 milhões de variantes genéticas que não estavam nos bancos de dados internacionais.
Mas por que isso importa?
“Vou te dar um exemplo: há uma mutação no gene BRCA1 que causa uma forma de câncer hereditária, que a família da Angelina Jolie teve. A maioria dos cânceres de mama não são inevitáveis. Mas existem algumas formas que são hereditárias. Aí nós achamos a mesma mutação em uma senhora de 93 anos que nunca teve câncer na vida”, conta Zatz.
“Ou seja, a mesma mutação que causou câncer de mama em três pessoas da família da Angelina Jolie, que tem um background europeu, não causou câncer de mama em uma pessoa com esse background miscigenado, que é a nossa população brasileira.”
Isso, segundo Zatz, muda totalmente o chamado aconselhamento genético realizado no Brasil, porque nem sempre uma mutação genética é realmente responsável por uma doença ou não.
“Se eu tivesse achado esta mutação em uma jovem, eu diria: ‘Olha, você tem um risco enorme de ter um câncer de mama. É melhor você tomar as precauções.’ Mas como a gente achou uma senhora que faleceu com 95 anos por outras causas e nunca teve câncer na vida, isso muda completamente como a gente interpreta as mutações.”
Este ramo do aconselhamento genético já beneficiou mais de 100 mil pessoas no Brasil, segundo Zatz. Isso sem contar as que ainda não nasceram.
“Hoje, com sequenciamento genômico, você pode fazer o diagnóstico com grande precisão. Você determina se existe risco para futuras crianças daquele casal, por exemplo. A gente oferece o teste para outras pessoas da família, se elas quiserem. E com isso, você previne o nascimento de novos afetados, principalmente em doenças graves, para as quais não há tratamento”, explica Zatz.
Ela afirma que a expressão aconselhamento genético é uma tradução imprecisa da expressão em inglês genetic counseling, porque o processo é uma orientação.
“A gente não aconselha porque a decisão do que fazer com aquela informação é do casal. Se a gente chega para o casal e diz: ‘Vocês têm alto risco de ter filhos com o mesmo problema’, eles querem esta informação, e podem lidar com esta informação da forma como acharem melhor.”
– Texto originalmente publicado em BBC News





































